CRISPR, дитя современной биологии, растет не по дням, а по часам. Он вырос из непонятной части бактериальной защитной иммунной системы в инструмент дл...
Читать далее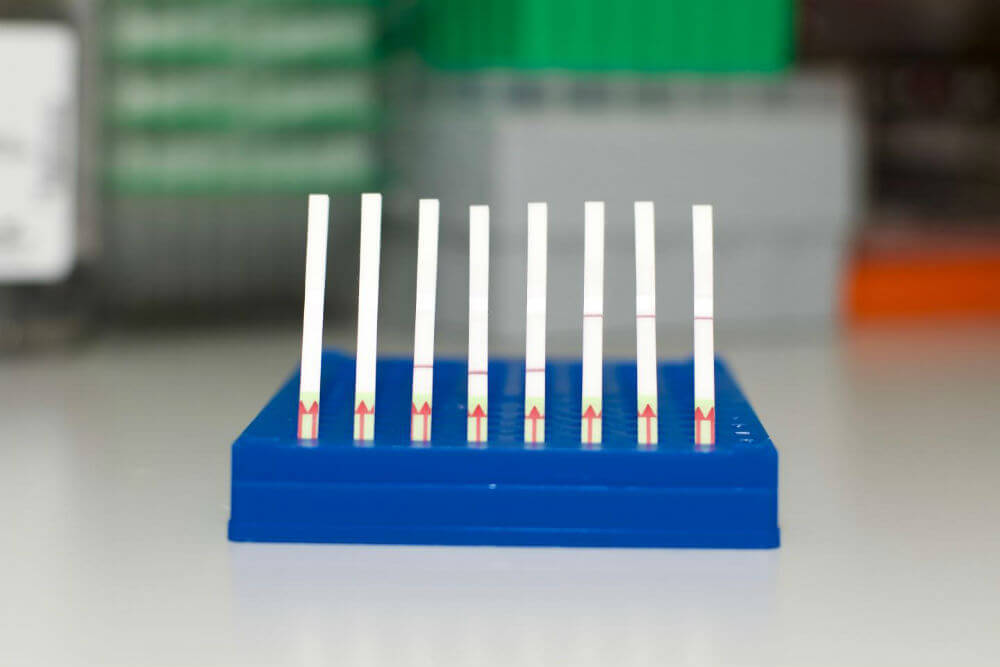
CRISPR, супергерой редактирования генов, стал чуточку мощнее. На прошлой неделе в Science было опубликовано три исследования, в которых ведущие лаборатории со всего мира представили новейшие дополнения к этой методике, преобразуя редактор генов в детектива вирусов или зоркого историка, который пересказывает всю историю клетки по ДНК. Как и CRISPR, эти новые технологии обзавелись забавными акронимами: CAMERA, DETECTR и SHERLOCK. Внезапный взрыв применений CRISPR четко показывает, что ученые изучили далеко не все потенциальные применения этой технологии.
Чтобы превратить CRISPR в настоящий мультитул, ученым пришлось исхитриться: CAMERA, клеточный рекордер, использует кольца ДНК для считывания истории клетки – например, чтобы узнать об антибиотиках или токсинах.
SHERLOCK, напротив, добавляется в «жертвенные» молекулы РНК, которые нарезаются в присутствии ДНК вируса или рака, чтобы вызвать положительный сигнал. Он проявляется в виде синей линии на бумажной полоске, как в тесте на беременность.
«Все это демонстрирует весьма творческие способы, к которым прибегают люди, чтобы заставить работать открытия в области CRISPR и создать эти синтетические пути», говорит доктор Дейв Сэвидж, белковый инженер из Калифорнийского университета в Беркли, не принимавший участия в исследованиях.
Клеточный рекордер
Черные ящики самолета являются ценным ресурсом для следователей, когда полет идет наперекосяк. Точно так же ученые долгое время надеялись изобрести клеточную машину времени, которая документирует события в жизни клетки – дозы радиации, всплески препаратов, приступы внутренней суматохи, которая приводит к ухудшению самочувствия клетки.
Что может быть лучше, чем изучить историю клетки в ДНК?
Доктор Дэвид Лю из Гарвардского университета воспользовался способностью CRISPR точно нарезать ДНК и разработал «молекулярного историка» по имени CAMERA (CRISPR-mediated analogue multi-event recording apparatus).
Вот как он работает. Для начала ученые изменяют направляющую CRISPR молекулу – «направляющую» РНК – в клетках бактерий, чтобы она срабатывала только после спуска курка: допустим, ввода антибиотика или другой химической атаки. После активации направляющая РНК выводит Cas9, ножницы CRISPR, в целевое местоположение. Без направляющей РНК не будет нарезки.
В дополнение к модифицированной системе CRISPR команда также дала клеткам два лишних кусочка ДНК, закодированных в круговой ДНК под названием плазмида. Обычно клетка экспрессирует две плазмиды с постоянной скоростью. Но как только активируется направляющая РНК, она (и Cas9) идет за одной из плазмид и съедает ее, оставляя другой нетронутым.
Следовательно, ученые могут с легкостью измерить соотношение двух плазмид. Используя эту систему, ученые смогли узнать, была ли клетка подвержена воздействию тетрациклина, известного антибиотика.
Эта первая система работала только с бактериальными клетками. Лю и его команда затем разработали вторую методику CAMERA, которая использует модифицированный Cas9. Вместо того чтобы срезать целевой ген, эти ножницы находят определенную букву ДНК и меняют ее на другую.
Как и прежде, система активируется только в ответ на определенные сигналы – препараты, питательные вещества, свет или даже сигнальные молекулы клетки, вроде тех, что связаны с раком. Рекордер не только записывает присутствие сигнала; считывая долю букв ДНК, которые подверглись замене, команда также может определить его длительность и силу.
В отличие от клеточных рекордеров предыдущего поколения, система Лю высокочувствительна и требует лишь десятка клеток для генерации сильного сигнала. SCRIBE, похожий рекордер, разработанный доктором Тимоти Лу в MIT еще в 2014 году, требует «на порядок» больше клеток, чтобы извлечь достаточно слабый сигнал.
CAMERA обладает и другими полезными функциями. Инструмент может, например, записывать несколько сигналов одновременно. Данные также можно стереть, используя препараты, которые возвращают соотношение плазмид к исходному уровню.
Лу впечатлен. Новая работа, по его словам, «действительно прекрасна» и «важна». Хотя любое медицинское применение потребует долгого пути, эта система может помочь в выявлении загрязнителей окружающей среды или же отслеживать определенные молекулярные сигналы, которые преобразуют стволовые клетки в нейроны, мышцы или другие типы клеток.
Охотники за вирусами
Два других исследования посвящены превращению CRISPR в чувствительный диагностический инструмент.
DETECTR использует преимущество менее известного собрата Cas9 – Cas12.
Как и Cas9, Cas12 следует за направляющей РНК в цель и срезает ее. Но на этом работа ножниц не останавливается. Группа под руководством Дженнифер Дудны, одного из изобретателей CRISPR в Калифорнийском университете Беркли, неожиданно обнаружила, что Cas12 остается активным после срезания цели – он мгновенно начинает охотиться за одноцепочечными молекулами ДНК, пытаясь их уничтожить.
Наблюдая за этой любопытной активностью, ученые решили добавить молекулярные неоновые сигналы в направляющую РНК, чтобы она светилась ярким зеленым цветом после активации Cas12.
Чтобы доказать концепцию, ученые изобрели несколько направляющих РНК, которые привязываются к разным штаммам вируса папилломы человека (ВПЧ), некоторые из которых вызывают рак шейки матки. Система DETECTR оказалась способна вычленить два особенно опасных штамма ВПЧ в бульоне из различных вирусных штаммов.
«Этот белок работает как надежный инструмент обнаружения ДНК из разных источников», говорит автор исследования Дженис Чен. «Мы хотим раздвинуть пределы технологии, которая имеет потенциальное применение в любой диагностической ситуации, где есть компонент ДНК, включая рак и инфекционные заболевания».
Обратная сторона? Прожорливость Cas12 может ограничить его использование для лечения генетических заболеваний у людей. Стартап Editas уже лицензировал Cas12 для дальнейшей разработки, и новая работа ученых может помешать его амбициозным планам.
Тем не менее сбрасывать Cas12 со счетов пока слишком рано. В то время как человеческая ДНК разматывается в одноцепочечную ДНК (и становится мишенью Cas12), этот фермент в основном связывается с геномной ДНК. Это ограничивает его способность охотиться на потенциальные одноцепочечные жертвы, объясняет доктор Фэн Чжн из Broad Institute, который написал работу по SHERLOCK.
SHERLOCK, основанный на системе, впервые разработанной в 2017 году, – Specific High Sensitivity Reporter unlocking – использует Cas13 в качестве режущего инструмента. У Cas13 тоже есть режим буйства, в который он погружается после уничтожения первоначальной цели.
В случае с SHERLOCK Чжан и его коллеги добавили «жертвенные» молекулы РНК, которые создают сигнал после расщепления. В присутствии вирусной ДНК или РНК – например, Зика, Эбола или вируса лихорадки денге – Cas13 кусает вирусную мишень и жертвенную РНК, высвобождая вместе с тем положительный сигнал.
SHERLOCK 2.0, о котором было рассказано в Science на прошлой неделе, в 100 раз чувствительнее оригинала и может обнаруживать до четырех различных целей одновременно.
Он также весьма практичен для полевого использования: все реагенты находятся в бумажной полосе, которая погружается в тестовый образец. Если появляется полоска, тест положительный – никаких дорогостоящих инструментов больше не нужно.
Как и DETECTR, это делает SHERLOCK особенно полезным во время вспышек. Технологию можно легко модифицировать для отслеживания других молекул ДНК в крови, например, которые обычно связаны с раком или стареющими клетками.
Вместе исследования подтверждают растущую исследовательскую тенденцию изучения приложений CRISPR за пределами генной терапии. По сравнению с терапией на основе CRISPR, которая требует многих лет тщательной проверки безопасности и эффективности, эти «альтернативные» способы могут спокойно войти в научный и диагностический поток гораздо быстрее.
Хотя новые трюки CRISPR требуют испытаний, эксперты настроены оптимистично.